| |
|
|
 |
Schedati i medici di medicina generale sponsorizzati ai convegni |
 |
 |
Inserito il 23 giugno 2006 da admin. - professione - segnala a:    
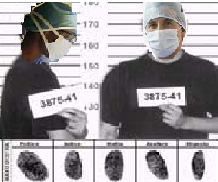 I medici di medicina generale e i pediatri di libera scelta sponsorizzati dalle aziende farmaceutiche verranno schedati dalle ASL, Regioni ed AIFA.
I medici di medicina generale e i pediatri di libera scelta sponsorizzati dalle aziende farmaceutiche verranno schedati dalle ASL, Regioni ed AIFA.
Art. 124 del decreto n. 219 del 24.04.06, Gazzetta Ufficiale n. 142 del 21.06.06 - Suppl. Ordinario n. 153
Convegni o congressi e altri incontri riguardanti i medicinali
1. Ogni impresa farmaceutica in possesso delle autorizzazioni previste dal titolo III o dal titolo IV, ovvero che, in base ad uno specifico accordo con il titolare dell'AIC, provvede all'effettiva commercializzazione di medicinali, che organizza o contribuisce a realizzare, mediante finanziamenti o erogazione di altre utilità anche indiretti, in Italia o all'estero, un congresso, un convegno o una riunione su tematiche comunque attinenti all'impiego di medicinali dalla stessa impresa prodotti o commercializzati, deve trasmettere al competente ufficio dell'AIFA, almeno sessanta giorni prima della data dell'inizio del congresso o incontro, una comunicazione, con firma autenticata, contenente i seguenti elementi:
a) propria denominazione o ragione sociale, codice fiscale e sede;
b) sede e data della manifestazione;
c) destinatari dell'iniziativa;
d) oggetto della tematica trattata, correlazione esistente fra questa e i medicinali di cui l'impresa è titolare, programma e razionale scientifico della manifestazione;
e) qualificazione professionale e scientifica dei relatori;
f) preventivo analitico delle spese; quando l'impresa si limita a fornire un contributo agli organizzatori, devono essere indicati l'entità e le modalità dello stesso, nonché eventuali diritti o facoltà concessi dagli organizzatori come corrispettivo.
2. Quando alla realizzazione di uno stesso congresso, convegno o riunione contribuiscono piu' imprese farmaceutiche, le comunicazioni di cui al comma 1 devono pervenire congiuntamente, per il tramite degli organizzatori, con un prospetto riepilogativo delle imprese partecipanti. Le comunicazioni inviate in difformità da quanto stabilito dal presente comma sono prive di efficacia.
3. Le manifestazioni di cui ai commi 1 e 2 devono attenersi a criteri di stretta natura tecnica ed essere orientate allo sviluppo delle conoscenze nei settori della chimica, tecnica farmaceutica, biochimica, fisiologia, patologia e clinica e devono realizzarsi nel rispetto di quanto previsto dal presente decreto e dei criteri e delle linee guida stabilite dall'AIFA ai sensi del comma 2 dell'articolo 119. E' vietata la partecipazione di imprese farmaceutiche a convegni o riunioni di carattere sindacale.
4. Nell'ambito delle manifestazioni di cui ai commi 1 e 2, eventuali oneri per spese di viaggio o per ospitalità devono essere limitati agli operatori del settore qualificati e non possono essere estesi ad eventuali accompagnatori. L'ospitalità non può, inoltre, eccedere il periodo di tempo compreso tra le dodici ore precedenti l'inizio del congresso e le dodici ore successive alla conclusione del medesimo, né presentare caratteristiche tali da prevalere sulle finalità tecnico-scientifiche della manifestazione. E' consentita ai medici di medicina generale ed ai pediatri di libera scelta la partecipazione a convegni e congressi con accreditamento ECM di tipo educazionale su temi pertinenti, previa segnalazione alla struttura sanitaria di competenza. Presso tale struttura e' depositato un registro con i dati relativi alle partecipazioni alle manifestazioni in questione; tali dati devono essere accessibili alle Regioni e all'AIFA.
5. L'impresa farmaceutica può realizzare o contribuire a realizzare il congresso, il convegno o la riunione se, entro quarantacinque giorni dalla comunicazione di cui al comma 1, l'AIFA comunica il proprio parere favorevole, sentita la Regione dove ha sede l'evento. L'impresa farmaceutica o, nell'ipotesi disciplinata dal comma 2, gli organizzatori dell'evento, devono inviare all'AIFA il consuntivo analitico delle spese.
6. Per le manifestazioni che si svolgono all'estero e per quelle che comportano, per l'impresa farmaceutica, un onere superiore a 25.822,85 euro, l'impresa stessa deve ottenere espressa autorizzazione dall'AIFA, che adotta le proprie determinazioni entro quarantacinque giorni dalla comunicazione di cui al comma 1, corredata dell'attestazione del pagamento della tariffa di cui all'articolo 158, comma 8, lettera b). Alle manifestazioni predette si applica il disposto del secondo periodo del comma 5.
7. In ogni caso, in seno al congresso o al convegno, o collateralmente allo stesso, non può essere effettuata alcuna forma
di distribuzione o esposizione di campioni di medicinali o di materiale illustrativo di medicinali, ad eccezione del riassunto delle caratteristiche del prodotto, degli atti congressuali e di lavori scientifici, purché integrali e regolarmente depositati presso l'AIFA ai sensi dell'articolo 120, comma 1. Limitatamente ai congressi internazionali, e' consentita la divulgazione, nelle lingue originali, di materiale informativo conforme alle AIC del medicinale rilasciate in altri Paesi, purché medici provenienti da questi ultimi risultino presenti alla manifestazione.
8. Le disposizioni del presente articolo si applicano ai congressi, convegni e riunioni di farmacisti su tematiche comunque attinenti ai medicinali.
9. Le imprese farmaceutiche di cui al comma 1 che organizzano o contribuiscono a realizzare mediante finanziamenti anche indiretti, in Italia o all'estero un congresso, un convegno o una riunione su tematiche che non attengono a medicinali dalle stesse prodotti o commercializzati non sono soggette alle disposizioni del presente articolo, fermo restando, per esse il divieto di svolgere in occasione delle manifestazioni, qualsiasi pubblicità presso gli operatori sanitari dei propri medicinali.
10. Se le manifestazioni di cui al presente articolo sono effettuate in violazione delle disposizioni del presente decreto e dei criteri e delle direttive stabilite dall'AIFA, l'Agenzia medesima può vietare lo svolgimento della manifestazione.
Commento di Luca Puccetti
E così è stata ribadita la schedatura dei MMG e PLS. Una sorta di categoria speciale da tenere sotto stretto controllo. Chiarissimo è il segnale che viene mandato: i MMG e i PLS sono a rischio di comportamenti illeciti più dei dipendenti del SSN o di Enti accreditati e vanno schedati. Non si comprende da chi dovrebbe essere fatta la segnalazione, forse dal medico stesso ? o dalla ditta che lo sponsorizza ? Già si sente puzza di incroci tra i profili di spesa e le segnalazioni di sponsorizzazione.... Nessun trattamento da sorvegliato speciale per i dipendenti, nemmeno per coloro che operano nei Centri autorizzati alla prescrizione dei farmaci di altissimo costo e che possono orientare la prescrizione di un' intera area vasta o regione. Nessun archivio speciale per chi partecipa o realizza clinical trials e gira il mondo a "spiegare" i mirabolanti risultati raggiunti passando da un aereo all'altro in una sorta di giostra perpetua.
|
 |
 |
Letto : 6600 | Torna indietro |  | |  | | 
|
 |
 |
 |
 |
|
|
|


